A continuación encontraras el listado de requisitos solicitado por patología específica, a través del Reglamento Operativo, para poder tramitar la medicación PACBI.
Esclerosis múltiple
Requisitos generales para el alta:
Resumen de historia clínica consignando:
- Forma clínica (brotes y remisiones, secundaria progresiva -con o sin brotes sobreimpuestos-, primaria progresiva).
- Detalle exhaustivo de evolución y brotes.
- Evaluación de escala de discapacidad EDSS y tiempo de deambulación de 7.5 metros.
- Descripción de tratamientos previos, respuesta a los mismos, efectos adversos presentados.
- RMN de cerebro con contraste (y médula espinal en caso de que corresponda) al menos 1 por año.
- El estudio de Bandas oligoclonales en LCR y suero (utilizando isoelectroenfoque e inmunofijación de IgG posterior.
- Potenciales evocados dependerá del criterio médico al momento del diagnóstico.
- Laboratorio de rutina incluyendo mínimamente: Hemograma, hepatograma, T3, T4, TSH, serología varicela y el resto según corresponda.
- Serología para virus JC en pacientes que soliciten Natalizumab (y en casos de sea positiva y continúen bajo tratamiento se solicitará RMN de cerebro cada 6 meses a fin de pesquisar formas de Leucoencefalopatía multifocal progresiva (LMP) tempranas asintomáticas, por lo que deberán presentar RMN actualizada. Índice VJC (ver más adelante).
Medicación
Indicado para Esclerosis múltiple recaída/remisión.
Requisitos para autorizar el suministro: Únicamente con los requisitos generales.
Parámetros de monitorización:
- Hemograma completo.
- Hepatograma.
- Función renal (a los 1, 3 y 6 meses y cada 3 meses a partir de entonces).
- Función de la tiroides al inicio y cada 6 meses.
Indicado para Esclerosis múltiple recaída/remisión.
Requisitos para autorizar el suministro: Únicamente con los requisitos generales.
Indicado para Esclerosis múltiple recaída/remisión, Esclerosis múltiple secundaria progresiva con recaídas.
Requisitos para autorizar el suministro: Únicamente con los requisitos generales.
Parámetros de monitorización:
- Hemograma completo.
- Hepatograma.
- Función renal (a los 1, 3 y 6 meses y cada 3 meses a partir de entonces).
- Función de la tiroides al inicio y cada 6 meses.
Indicado para Esclerosis múltiple recaída/remisión, Esclerosis múltiple secundaria progresiva con recaídas.
Requisitos para autorizar el suministro: Únicamente con los requisitos generales.
Parámetros de monitorización:
- Hemograma completo.
- Hepatograma.
- Función renal (a los 1, 3 y 6 meses y cada 3 meses a partir de entonces).
- Función de la tiroides al inicio y cada 6 meses.
Indicado para Esclerosis múltiple recaída/remisión.
Requisitos para autorizar el suministro: Únicamente con los requisitos generales.
Parámetros de monitorización:
- Hemograma completo.
- Hepatograma.
- Función renal (a los 1, 3 y 6 meses y cada 3 meses a partir de entonces).
- Función de la tiroides al inicio y cada 6 meses.
- ECG informado (basal, repetir después del período de observación de dosis inicial).
- Examen oftalmológico al inicio del estudio y de 3 a 4 meses después del inicio del tratamiento
(continuar los exámenes periódicos de la duración de la terapia). - Anticuerpos VZV (pacientes sin antecedentes de varicela confirmados por profesional de la salud o sin varicela previa documentada de vacuna VZV de serie completa).
- Anticuerpo anti-JCV según corresponda.
Indicado para Esclerosis múltiple: Tratamiento de pacientes con formas recurrentes de esclerosis múltiple.
Requisitos para autorizar el suministro: Únicamente con los requisitos generales.
Parámetros de monitorización:
- Hemograma completo.
- Hepatograma.
- Función renal (a los 1, 3 y 6 meses y cada 3 meses a partir de entonces).
- Función de la tiroides al inicio y cada 6 meses.
- Detección de tuberculosis y embarazo antes de la terapia.
Indicado para Esclerosis múltiple: Tratamiento de pacientes con formas recurrentes de esclerosis múltiple.
Requisitos para autorizar el suministro: Únicamente con los requisitos generales.
Parámetros de monitorización:
- Hemograma completo.
- Hepatograma.
- Función renal.
- Orina completa (a los 1, 3 y 6 meses y cada 3 meses a partir de entonces).
- Anticuerpo anti-JCV y detección de MRI para PML según corresponda.
Indicado para Esclerosis múltiple recaída remisión. Tratamiento de pacientes con formas recurrentes de esclerosis múltiple (EM), generalmente reservado para pacientes que han tenido una respuesta inadecuada a 2 o más medicamentos indicados para el tratamiento de la EM.
Requisitos para autorizar el suministro: Únicamente con los requisitos generales.
Parámetros de monitorización:
- Hemograma completo.
- Hepatograma.
- Función renal (a los 1, 3 y 6 meses y cada 3 meses a partir de entonces).
- Serología para virus JC en pacientes que soliciten Natalizumab: en caso de que los anticuerpos resulten negativos se debe realizar RMN de cerebro y serología cada 6 meses. En los casos en los que los anticuerpos anti VJC sean POSITIVOS, se debe monitorear según el siguiente esquema.
Indicado para Esclerosis múltiple, recaída. Tratamiento de pacientes con formas recurrentes de esclerosis múltiple (EM), generalmente reservado para pacientes que han tenido una respuesta inadecuada a 2 o más medicamentos indicados para el tratamiento de la EM.
Requisitos para autorizar el suministro: Únicamente con los requisitos generales.
Parámetros de monitorización:
- Hemograma completo antes de la iniciación y, luego, mensualmente hasta 48 meses después de la última infusión.
- Creatinina sérica antes del inicio y luego mensualmente hasta 48 meses después de la última infusión o en cualquier momento durante el tratamiento si está clínicamente indicado.
- Análisis de orina con recuentos de células de orina (antes de la iniciación y luego mensualmente).
- TSH al inicio del estudio y cada 3 meses hasta 48 meses después de la última perfusión o más tiempo o en cualquier momento durante el tratamiento si está clínicamente indicado.
- ECG antes de cada curso de tratamiento.
- Detección anual de HPV.
- PPD.
- Exámenes iniciales y anuales de la piel (para el melanoma).
Hipertensión pulmonar
La HP se define como un aumento de la presión arterial pulmonar (PAP) media (PAPm) ≥ 25 mmHg en reposo, calculada mediante cateterismo cardiaco derecho (CCD). Los datos disponibles muestran que la PAPm normal en reposo es 14 ± 3 mmHg, con un límite superior de la normalidad de aproximadamente 20 mmHg. El término HAP describe a un grupo de pacientes con HP caracterizados hemodinámicamente por HP precapilar, definida por una presión de enclavamiento pulmonar (PEP) ≤ 15 mmHg y una RVP > 3 UW en ausencia de otras causas de HP precapilar, como la HP causada por enfermedades pulmonares, HPTC u otras enfermedades raras.
Clasificación
Grupo 1: Hipertensión arterial pulmonar que puede ser idiopática, heredable, inducida a drogas o toxinas y asociadas con VIH, enfermedades del tejido conectivo, etc.
Grupo 2: Hipertensión Pulmonar secundaria a cardiopatía izquierda.
Grupo 3: Hipertensión pulmonar secundaria a enfermedades pulmonares/hipoxia.
Grupo 4: Hipertensión pulmonar tromboembólica crónica y otras obstrucciones de arterias pulmonares.
Grupo 5: Hipertensión pulmonar de mecanismo desconocido y/o multifactorial.
Diagnóstico
- Resumen de historia clínica (inicio de los síntomas, evolución en el tiempo, estado actual del paciente, examen físico minucioso).
- ECG: Solo si la HTP es grave se podrán ver alteraciones en el mismo (P pulmonale, desviación del eje a la derecha, hipertrofia VD, BCRD, FA, etc.), de inicio a la consulta.
- Radiografía de tórax: 90% de pacientes con HAPI (Hipertensión Arterial Pulmonar Idiopática), es anormal. Dilatación de arteria pulmonar central, agrandamiento AD y VD, de inicio a la consulta.
- Gasometría Arterial (de ser necesario), según causa de la HTP.
- Ecocardiograma con doppler color con mediciones de cavidades derechas, TAPSE, etc.: Al inicio y cada 6 meses. Ecocardiograma Transesofágico /RMC si hay cardiopatía congénita, embolias embarazadas, HPTC.
- Test de la marcha de los 6 minutos (TM6M): Al inicio y cada 3 a 6 meses para evaluar evolución.
- Prueba de Esfuerzo Cardiopulmonar: Si se cuenta con el mismo, al inicio del tratamiento, y cada 3 a 6 meses.
- Laboratorio: (Hemograma completo, función hepática y renal, función tiroidea, serología para HIV, VHB y VHC y perfil inmunológico en búsqueda de esclerosis sistémicas u otras patologías que puedan cursar con la misma, tener en cuenta NT- ProBNP, anticuerpo anticentromérico, anti RNP U1 y U3).
- Test de Embarazo al inicio y si posteriormente se decide tratamiento, realizar monitoreo mensual y hasta un mes después de suspendida la medicación.
- Tac de Tórax de Alta Resolución: agrandamiento de AP o el VD, causa de HP (enfermedad pulmonar, HPTC).
- Gammagrafía ventilación perfusión: Cuando hubo por ejemplo un TEP.
- Cateterismo cardiaco derecho (confirma la HTP), evaluar síntomas y si responde a medicación y teste de vasorreactividad para ver si el paciente responde a BCC.
- Ecografía Abdominal y Eco doppler portal: si hay HT portal.
Medicación
Indicado para pacientes con HAPI y HAP asociada a ETC e infección por el VIH.
Requisitos de seguimiento
- Clínico por médico especialista (Neumólogo/ Cardiólogo) evaluando fundamentalmente Disnea por Clase Funcional de la OMS-FC.
• ECG: Basal, de los 3 a 6 meses de iniciado el tratamiento, de los 3 a 6 meses de cambio de tratamiento y ante empeoramiento clínico.
• TM6M: Basal, de los 3 a 6 meses de iniciado el tratamiento, de los 3 a 6 meses de cambio de tratamiento y ante empeoramiento clínico.
• Ecocardiograma con doppler color: Basal y cada 6 meses.
• Laboratorio de sangre básico: Basal, de los 3 a 6 meses de iniciado el tratamiento, de los 3 a 6 meses de cambio de tratamiento y ante empeoramiento clínico. Incluir en el mismo, hemograma y hepatograma (GOT, GPT, Bilirrubina total y fraccionada), Ionograma (Sodio y Potasio), sobre todo si el paciente se encuentra en tratamiento con los receptores de Endotelina, NT- Pro-BNP, RIN.
• Laboratorio de Sangre ampliado: TSH, Ac Úrico, perfil férrico (hierro, ferritina, transferrina, según la
causa de la HTP).
• Prueba de esfuerzo cardiopulmonar: Basal y cada 6 a 12 meses y ante empeoramiento clínico.
Indicado para HAP (idiopática, asociada a ETC y síndrome de Eisenmenger).
Requisitos de seguimiento
- Clínico por médico especialista (Neumólogo/ Cardiólogo) evaluando fundamentalmente Disnea por Clase Funcional.
- ECG: Basal, de los 3 a 6 meses de iniciado el tratamiento, de los 3 a 6 meses de cambio de tratamiento y ante empeoramiento clínico.
- TM6M: Basal, de los 3 a 6 meses de iniciado el tratamiento, de los 3 a 6 meses de cambio de
tratamiento y ante empeoramiento clínico - Ecocardiograma con doppler color: Basal y cada 6 meses.
- Laboratorio de sangre básico: Basal, de los 3 a 6 meses de iniciado el tratamiento, de los 3 a 6 meses de cambio de tratamiento y ante empeoramiento clínico. Incluir en el mismo, hemograma y hepatograma (GOT, GPT, Bilirrubina total y fraccionada), Ionograma (Sodio y Potasio), sobre todo si el paciente se encuentra en tratamiento con los receptores de Endotelina, NT- Pro-BNP, RIN.
- Laboratorio de Sangre ampliado: TSH, Ac Úrico, perfil férrico (hierro, ferritina, transferrina, según la
causa de la HTP). - Prueba de esfuerzo cardiopulmonar: Basal y cada 6 a 12 meses y ante empeoramiento clínico.
Indicado para HAP (idiopática, asociada a ETC y síndrome de Eisenmenger).
Requisitos de seguimiento
- Clínico por médico especialista (Neumólogo/ Cardiólogo) evaluando fundamentalmente Disnea por Clase Funcional.
- ECG: Basal, de los 3 a 6 meses de iniciado el tratamiento, de los 3 a 6 meses de cambio de tratamiento y ante empeoramiento clínico
- TM6M: Basal, de los 3 a 6 meses de iniciado el tratamiento, de los 3 a 6 meses de cambio de
tratamiento y ante empeoramiento clínico. - Ecocardiograma con Doppler color: Basal y cada 6 meses.
- Laboratorio de sangre básico: Basal, de los 3 a 6 meses de iniciado el tratamiento, de los 3 a 6 meses de cambio de tratamiento y ante empeoramiento clínico. Incluir en el mismo, hemograma y hepatograma (GOT, GPT, Bilirrubina total y fraccionada), Ionograma (Sodio y Potasio), sobre todo si el paciente se encuentra en tratamiento con los receptores de Endotelina, NT- Pro-BNP, RIN.
- Laboratorio de Sangre ampliado: TSH, Ac Úrico, perfil férrico (hierro, ferritina, transferrina, según la
causa de la HTP). - Prueba de esfuerzo cardiopulmonar: Basal y cada 6 a 12 meses y ante empeoramiento clínico.
Indicado para Hipertensión Arterial Pulmonar (HAP) o Hipertensión Pulmonar Tromboembólica Crónica (HPTC).
Requisitos de seguimiento
- Clínico por médico especialista (Neumólogo/ Cardiólogo) evaluando fundamentalmente Disnea por Clase Funcional.
- ECG: basal, de los 3 a 6 meses de iniciado el tratamiento, de los 3 a 6 meses de cambio de tratamiento y ante empeoramiento clínico.
- TM6M: basal, de los 3 a 6 meses de iniciado el tratamiento, de los 3 a 6 meses de cambio de
tratamiento y ante empeoramiento clínico. - Ecocardiograma con doppler color: basal y cada 6 meses.
- Laboratorio de sangre básico: basal, de los 3 a 6 meses de iniciado el tratamiento, a los 3 a 6 meses de cambio de tratamiento y ante empeoramiento clínico. Incluir en el mismo, hemograma y hepatograma (GOT, GPT, Bilirrubina total y fraccionada), Ionograma (Sodio y Potasio), sobre todo si el paciente se encuentra en tratamiento con los receptores de Endotelina, NT- Pro-BNP, RIN.
- Laboratorio de Sangre ampliado: TSH, Ac Úrico, perfil férrico (hierro, ferritina, transferrina, según la
causa de la HTP). - Prueba de esfuerzo cardiopulmonar: basal y cada 6 a 12 meses y ante empeoramiento clínico.
Indicado para tratamiento de la hipertensión arterial pulmonar (HAP) (hipertensión arterial pulmonar idiopática o heredable e hipertensión arterial pulmonar asociada a enfermedades del tejido conjuntivo) en pacientes con síntomas pertenecientes a las Clases funcionales III y IV según la OMS para mejorar la capacidad de ejercicio; en hemodiálisis en situaciones de emergencia cuando la utilización de heparina conlleva un alto riesgo de causar o exacerbar la hemorragia o cuando la heparina está contraindicada.
Requisitos para su suministro
- Clínico por médico especialista (Neumólogo/ Cardiólogo) evaluando fundamentalmente Disnea por Clase Funcional.
- ECG: Basal, de los 3 a 6 meses de iniciado el tratamiento, de los 3 a 6 meses de cambio de tratamiento y ante empeoramiento clínico.
- TM6M: Basal, de los 3 a 6 meses de iniciado el tratamiento, de los 3 a 6 meses de cambio de tratamiento y ante empeoramiento clínico
- Ecocardiograma con doppler color: basal y cada 6 meses.
- Laboratorio de sangre básico: Basal, de los 3 a 6 meses de iniciado el tratamiento, de los 3 a 6 meses de cambio de tratamiento y ante empeoramiento clínico. Incluir en el mismo, hemograma y hepatograma (GOT, GPT, Bilirrubina total y fraccionada), Ionograma (Sodio y Potasio), sobre todo si el paciente se encuentra en tratamiento con los receptores de Endotelina, NT- Pro-BNP, RIN.
- Laboratorio de Sangre ampliado: TSH, Ac Úrico, perfil férrico (hierro, ferritina, transferrina, según la causa de la HTP).
- Prueba de esfuerzo cardiopulmonar: Basal y cada 6 a 12 meses y ante empeoramiento clínico.
- Cateterismo Cardiaco Derecho: Basal y cada 6 a 12 meses, cambio de tratamiento o ante empeoramiento clínico (según disponibilidad)
Indicado para pacientes con Hipertensión Arterial Pulmonar (HAP).
Requisitos para el seguimiento
- Clínico por médico especialista (Neumólogo/ Cardiólogo) evaluando fundamentalmente Disnea por Clase Funcional.
- ECG: Basal, de los 3 a 6 meses de iniciado el tratamiento, de los 3 a 6 meses de cambio de tratamiento y
ante empeoramiento clínico. - TM6M: Basal, de los 3 a 6 meses de iniciado el tratamiento, de los 3 a 6 meses de cambio de
tratamiento y ante empeoramiento clínico - Ecocardiograma con doppler color: basal y cada 6 meses.
- Laboratorio de sangre básico: Basal, de los 3 a 6 meses de iniciado el tratamiento, de los 3 a 6 meses de cambio de tratamiento y ante empeoramiento clínico. Incluir en el mismo, hemograma y hepatograma (GOT, GPT, Bilirrubina total y fraccionada), Ionograma (Sodio y Potasio), sobre todo si el paciente se encuentra en tratamiento con los receptores de Endotelina, NT- Pro-BNP, RIN.
- Laboratorio de Sangre ampliado: TSH, Ac Úrico, perfil férrico (hierro, ferritina, transferrina, según la
causa de la HTP). - Prueba de esfuerzo cardiopulmonar: Basal y cada 6 a 12 meses y ante empeoramiento clínico.
- Cateterismo Cardiaco Derecho: Basal y cada 6 a 12 meses, cambio de tratamiento o ante empeoramiento clínico.
Enfermedad de Pompe
El diagnóstico se de a partir del dosaje de la actividad enzimática de la enzima alfa-glucosidasa ácida en gota de sangre seca (DBS) y
confirmación mediante: actividad enzimática en leucocitos (o linfocitos, músculo o fibroblastos) o hallazgo de las dos mutaciones mediante estudio molecular.
Documentación a presentar
- Resultado de dosaje de actividad enzimática en DBS + dosaje de actividad enzimática en leucocitos o estudio
genético molecular en el que se documenten dos mutaciones causantes de la enfermedad de Pompe en gen AGA. - Historia clínica mencionando el peso del paciente.
- Informe de estudios.
Estudios para la forma tardía, basales para inicio de tratamiento y estudios de seguimiento para continuar suministro:
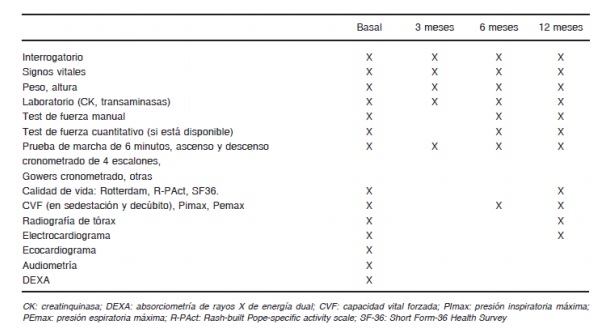
Estudios recomendables, pero No excluyentes para inicio de tratamiento o continuación de suministro
- Escalas de Calidad de vida
- Audiometría
- DEXA
Forma Infantil
En la forma Infantil se recomienda
- Peso, talla.
- Laboratorio incluyendo CPK, GOT, GPT.
- Examen neurológico /muscular y del neurodesarrollo.
- Evaluación cardiológica: Ecocardiograma y ECG.
- Radiografía de tórax.
- Frecuencia respiratoria, Oximetría de pulso, gases en sangre.
- CV durante el llanto.
Enfermedad de Gaucher
Diagnóstico: Se basa en el dosaje enzimático de la enzima β-Glucocerebrosidsa. La actividad enzimática puede ser medida en gota de sangre seca (DBS) y confirmada en leucocitos o cultivo de fibroblastos.
Documentación a presentar:
- Historia clínica completa.
- Medición de la actividad de la enzima deficiente en leucocitos, plasma o fibroblastos.
- Laboratorio: Hemograma con recuento de plaquetas, Calcio/P.
- Coagulograma. AL DIAGNÓSTICO
- Proteinograma electroforético: > 30 años.
- Radiografía simple frente de ambas caderas y ambos fémures.
- Radiografía simple de columna dorsolumbar.
- Radiografía simple de un sitio doloroso. ANTE EVENTO AGUDO, NO DE RUTINA
- Edad ósea: pacientes pediátricos.
- Ecografía abdominal.
DXA: DE INICIO. SI ES NORMAL NO SE REQUIERE EN FORMA ANUAL
Recomendaciones para estudios y seguimiento
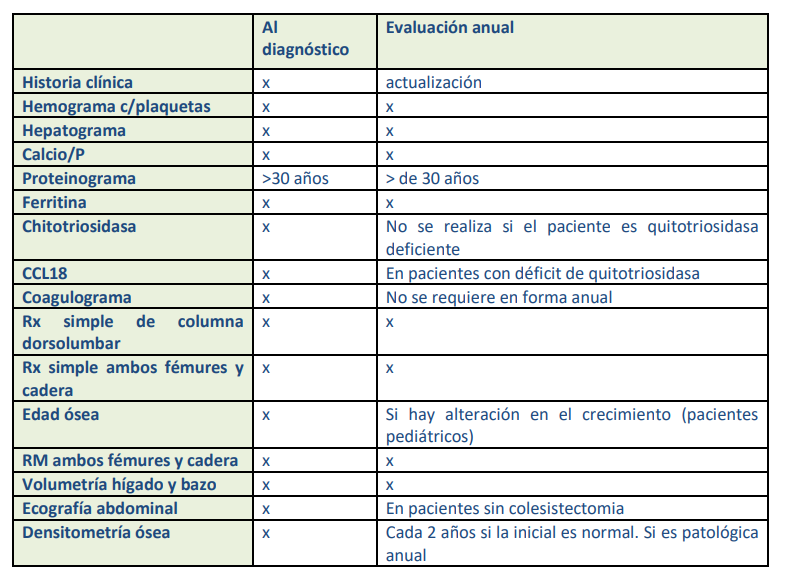
Medicación
Terapia de reemplazo enzimático
Requisitos de solicitud: Únicamente los requisitos generales.
Indicado para Enfermedad de Gaucher tipo I.
Requisitos para autorizar su suministro
- Historia clínica completa.
- Medición de la actividad de la enzima deficiente en leucocitos, plasma o fibroblastos.
- Evaluación neurológica (incluye RMN columna cervical, estudios de deglución, potenciales evocados auditivos).
- Evaluación respiratoria (polisomnografía).
- Evaluación cardiológica.
- Evaluación oftalmológica.
- Laboratorio: Hemograma con recuento de plaquetas, Calcio/P, Coagulograma.
- Proteinograma electroforética: > 30 años.
- Imágenes: Radiografía simple frente de ambas caderas y ambos fémures; Rx simple de columna dorsolumba; radiografía simple de un sitio doloroso; edad ósea: pacientes pediátricos; ecografía abdominal; DXA.
Requisitos para continuar su suministro
- Laboratorio anual.
- RMN idem al diagnóstico en forma anual.
- Radiografía simple ante la presencia de síntomas que presuponen fractura u otro síntoma.
- Ecografía abdominal anual si presenta cálculos biliares de lo contrario cada 3 años
- DXA: anual en aquellos pacientes con osteopenia u osteoporosis, o bien en terapia con medicación
coadyuvante, de lo contrario cada 2 años.
Es una terapia de reducción de sustrato, indicada en personas mayores a 18 años.
Requisitos de autorización: Únicamente los requisitos generales.
Es un inhibidor de la enzima glucosilceramide sintetasa, indicado para Enfermedad de Gaucher tipo I. (como segunda línea de tratamiento, reservada para pacientes no candidatos a reemplazo enzimático).
Requisitos para autorizar su suministro
- Historia clínica completa.
- Medición de la actividad de la enzima deficiente en leucocitos, plasma o fibroblastos.
- Evaluación neurológica (incluye RMN columna cervical, estudios de deglución, potenciales evocados auditivos).
- Evaluación respiratoria (polisomnografía).
- Evaluación cardiológica.
- Evaluación oftalmológica.
- Laboratorio: Hemograma con recuento de plaquetas, Calcio/P, Coagulograma.
- Proteinograma electroforética: > 30 años.
- Imágenes: Radiografía simple frente de ambas caderas y ambos fémures; radiografía simple de columna dorsolumbar; radiografía x simple de un sitio doloroso; Edad ósea: pacientes pediátricos; Ecografía abdominal; DXA.
Requisitos para continuar con su suministro
- Laboratorio anual.
- RMN idem al diagnóstico en forma anual.
- Radiografía simple ante la presencia de síntomas que presuponen fractura u otro síntoma.
- Ecografía abdominal anual si presenta cálculos biliares de lo contrario cada 3 años.
- DXA: anual en aquellos pacientes con osteopenia u osteoporosis, o bien en terapia con medicación coadyuvante, de lo contrario cada 2 años.
Enfermedad de Fabry
Diagnóstico
- El dosaje de la actividad enzimática de la enzima alfa-galactosidasa A es suficiente para el diagnóstico en hombres.
- En mujeres, se requiere la demostración de la mutación en el gen GLA causante de la enfermedad de Fabry ya que pueden presentar actividad enzimática en valores normales.
- La actividad enzimática puede ser medida en plasma, leucocitos o en gota de sangre seca (DBS).
Medicación
Dosis: 1 mg/Kg cada 15 días.
Requisitos de autorización: Únicamente los requisitos generales.
Indicaciones para el tratamiento
- En pacientes hombres con fenotipo clásico, el tratamiento debe ser iniciado en edad pediátrica. Si el diagnóstico se realiza en edad adulta el tratamiento debe comenzar en forma inmediata.
- En mujeres con fenotipo clásico, si existen síntomas característicos se debe iniciar tratamiento a la brevedad. Cuando no se evidencian síntomas en mujeres con fenotipo clásico, la presencia de signos de compromiso renal, cardiaco o cerebrovascular en el laboratorio, imágenes o biopsia, justifican iniciar el tratamiento.
- En pacientes adultos con fenotipo de inicio del adulto (Fabry tipo 2), la terapia de reemplazo puede diferirse hasta que se presenten signos o síntomas característicos de la enfermedad o se demuestre daño tisular activo en la biopsia renal y/o cardíaca.
Requisitos para la autorización
- Resultado del estudio de actividad enzimática en el caso de los varones.
- Resultado del estudio molecular genético en el que se documente una mutación causante de la enfermedad de Fabry en el gen GLA.
- Historia clínica mencionando el peso del paciente.
- Informe de estudios:
1. Renal: Filtrado glomerular (FG) medido o calculado. Albuminuria o Proteinuria en recolección de orina 24 hs o en muestra al azar. Basal y cada 3 meses
2. Cardíaco: ECG, Ecocardiograma. No excluyentes y en casos puntuales: RMN cardíaca con contraste o T1 mapping. Basal y Anual
3. Cerebro vascular: RNM de cerebro con angioRNM de vasos intracraneales (No recomendado en niños) o TC de cerebro sin contraste en caso de contraindicación a la RNM (no recomendado en niños). Basal y anual
4. Sistema nervioso periférico: No excluyentes, en caso de manifestación de dolor, evaluación e historial del dolor medidos por escalas validadas (BPI3 o Neuropatic Pain System Inventory), QST. Evaluación de síntomas autonómicos: TA en decúbitos para ortostatismo.
5. Oído: No excluyente, solo a criterio: audiometría, nistagmografía
6. Pulmonar: Rx tórax. Basal y anual
7. Oftalmológico: No excluyente: evaluación de córnea mediante lámpara de hendidura.
8. Bioquímico: Lyso GL-3. Basal y cada 3 a 6 meses.
Mucopolisacaridosis I
Diagnóstico: Se basa en el dosaje enzimático de la enzima ALFA L IDURONIDASA. La actividad enzimática puede ser medida en gota de sangre seca (DBS, como screening) y confirmada en leucocitos.
Requisitos para el inicio del trámite
- Resultado de dosaje de actividad enzimática en DBS + dosaje de actividad enzimática en leucocitos o estudio genético molecular en el que se documenten dos mutaciones causantes de la enfermedad de MPSI en gen IDUA.
- Historia clínica completa mencionando datos antropométricos del paciente
- Dosaje de Glicosaminoglicanos en orina basal.
Informe de estudios
Los pacientes con MPS I requieren una evaluación basal completa datos objetivos del cuadro clínico y un seguimiento regular periódico que permitirá detectar precozmente complicaciones y supervisar la respuesta al tratamiento. Se proponen los siguientes estudios basales y de seguimiento cada 6 meses:
- Evaluación cardiovascular:
a. ECG
b. Ecocardiograma - Evaluación respiratoria y del índice de apneas:
a. Polisomnografía (Recomendable, no excluyente. Inicial y anual)
b. Espirometría (dependiendo de la edad del paciente y estado de maduración intelectual) - Evaluación radiológica:
a. Rx de columna dorsolumbar frente y perfil
b. Columna cervical con extrema precaución por la frecuencia de displasia de las apófisis odontoides
c. Cráneo perfil
d. Cadera
e. Manos de frente
f. Rx tórax frente - Evaluación neurológica (Recomendable, no excluyente)
a. Evaluación de la estabilidad cervical:
i.RMN de columna cervical
b. Evaluar signos y síntomas sospechosos de hidrocefalia y/o hipertensión endocraneana.
i.En el centro especializado que realiza el control, evaluarán la necesidad de realizar TAC o RMN de cerebro. - Evaluación oftalmológica (recomendable, no excluyente)
a. Agudeza visual disminuida por opacidad corneal. (Se valora examinando con lámpara de hendidura).
b. Fondo de ojo: pérdida de la visión periférica y ceguera como resultado de la degeneración retiniana y de la disfunción de conos respectivamente
c. Medición de la presión intraocular: para evaluar glaucoma.
MUY IMPORTANTE:
Anestesia: frente a estudios o tratamientos que requieran anestesia, deben tenerse en cuenta que debe realizarse solo en centros con experiencia, por las severas dificultades que pueden existir con estos pacientes. La intubación puede ser dificultosa como consecuencia de la infiltración por glicosaminoglicanos en todo el tracto respiratorio, las secreciones aumentadas, el cuello corto, la limitación de los movimientos de la mandíbula y la lengua grande. Es recomendable una fibroscopía de la vía aérea superior. Puede ser necesario realizar una traqueotomía de urgencia en casos de complicaciones durante el procedimiento anestésico.
Medicación disponible para el tratamiento
a razón de 0,58mg/kg/semana en infusión endovenosa a intervalos crecientes según prospecto: se realiza la administración peritrasplante. Se recomienda continuar con la TRE hasta certificar un injerto exitoso con quimerismo del 80%o mayor y actividad enzimática del donante normal.
Trasplante de células madre hematopoyéticas (TCMH): Se recomienda para las formas severas cuando el deterioro cognitivo no es profundo. Las recomendaciones vigentes recomiendan la evaluación del estatus cognitivo según las técnicas mencionadas más delante de acuerdo a la edad del paciente. Para el caso del trasplante se prefiere que el paciente tenga un coeficiente intelectual (CI) de al menos 70, y una edad de hasta 2 años. Igualmente, el parámetro fundamental es la valoración del CI. En menores de 3 años se recomienda utilizar la prueba de Bayley, entre los 3 y 5 años la prueba de Wipssi y entre los 6 y 16 años la prueba de WISC-III
Para las formas atenuadas:
El único tratamiento disponible es la terapia de reemplazo enzimático con LARONIDASA a razón de 0,58mg/kg/semana en infusión endovenosa a intervalos crecientes según prospecto. El paciente debe ser evaluado según las normas antedichas para prevenir complicaciones secundarias a la progresión de la enfermedad. El tratamiento es de por vida.
Mucopolisacaridosis II
Es una enfermedad genética hereditaria, ligada al cromosoma X, de la clase de las enfermedades de depósito lisosomal (EDLs). Causado por la deficiencia de una enzima llamada iduronato-2-sulfatasa.
Medicación disponible para el tratamiento
Presentación y dosis: Idursulfasa 0,5 mg/kg en infusiones semanales.
Requisitos para autorizar su suministro
- Historia clínica que incluya peso.
- Laboratorio que incluya función renal y hepática.
- Índice de calidad de vida.
- Control cardiológico.
- Control respiratorio.
- Control neurológico.
- Imágenes óseas si hay lesión.
Documentación para continuar su suministro
Cada 3 meses
- Laboratorio que incluya función renal y hepática.
- Ausencia de enfermedad infecciosa aguda.
Exclusiones
- Enfermedad cerebral Terminal.
- Menores de 5 años.
Mucopolisacaridosis tipo IV (Enfermedad de Morquio A)
Medicación disponible para el tratamiento
Es una terapia de reemplazo enzimático.
Requisitos para autorizar su suministro
- Historia clínica que incluya peso.
- Laboratorio que incluya función renal y hepática.
- Índice de calidad de vida.
- Control cardiológico.
- Control respiratorio.
- Control neurológico.
- Imágenes óseas si hay lesión. Control traumatológico.
Requisitos para continuar con su suministro
- Laboratorio que incluya función renal y hepática.
- Ausencia de enfermedad infecciosa aguda.
Exclusiones: Menores de 5 años.
Mucopolisacaridosis tipo VI (Síndrome de Maroteaux – Lamy)
Es una enfermedad de almacenamiento lisosómico con afectación sistémica progresiva, asociada a un déficit de arilsulfatasa B (ASB) que conduce a una acumulación de dermatán sulfato.
Medicación disponible para el tratamiento
Indicado para Reemplazo enzimático con N- acetilgalactosamine -4-sulfatasa recombinante humana.
Documentación para el alta
- Historia clínica actualizada.
- Control respiratorio.
- Control cardiológico.
- Control traumatológico.
- Control neurológico.
- Control oftalmológico.
- Audiometría.
- Imágenes óseas si hay lesión.
- Laboratorio que incluya función hepática.
Documentación para continuar medicación
- Control cardiológico.
- Control respiratorio.
- Control traumatológico.
- Control neurológico.
- Laboratorio que incluya función hepática.
Exclusiones: Niños menores de 5 años
Hemofilia
Se dará cobertura en los siguientes casos:
1. Hemofilia tipo A: Déficit de factor VIII.
2. Hemofilia tipo B: Déficit de factor IX.
3. Enfermedad de Von Willebrand tipo III
Inclusiones
- Tratamiento farmacológico profiláctico con factor VIII, VIIr, concentrados de complejo de protombina activada (CCPA Feiba) o IX.
- Tratamiento farmacológico a demanda con factor VIIr, VIII CCPA (Feiba) o IX.
- Tratamiento farmacológico profiláctico con factor VIII a altas dosis (inmunotolerancia-ITT) para pacientes con elevado título de inhibidor de Factor VIII.
- Tratamiento farmacológico con factor VIII más factor de VW en enfermedad de Von Willebrand.
Modalidad de provisión de Factor VIII (plasmático y recombinante)
- Hemofilia A grave en profilaxis: Sistema de Compra Consolidada.
- Hemofilia A grave en inmunotolerancia con altas dosis de factor VIII: Sistema de Compra Consolidada.
- Hemofilia A grave con inhibidor de alto título con CCPA (Feiba) o Factor VIIr: Fuera de cápita. No vía de excepción. Gestión a cargo de la UGP.
- Hemofilia A grave en profilaxis con evento agudo o programado: Fuera de cápita. No vía de excepción. Gestión a cargo de la UGP.
- Hemofilia A grave con tratamiento a demanda: Fuera de cápita. No es vía de excepción. Gestión a cargo de la UGP.
- Hemofilia A moderada o leve: Fuera de cápita. No es vía de excepción. Gestión a cargo de la UGP.
- Hemofilia B en profilaxis o con tratamiento a demanda: Fuera de cápita. No es vía de excepción. Gestión a cargo de la UGP.
- Enfermedad de Von Willebrand tipo III: Fuera de cápita. No es vía de excepción. Gestión a cargo de la UGP.
Para el alta en Egov se deberá enviar una historia clínica completa, incluyendo copias de las determinaciones que avalen el diagnóstico de la patología, así como también el dosaje de inhibidores.
La actualización de la historia clínica deberá realizarse cada 3 (tres) meses.
Para el alta en el Sistema de Compra Consolidada, además de la historia clínica, deberán enviar el formulario para la solicitud de Factor VIII en el SCC con TODOS los datos completos y legibles.
- Fecha de la prescripción.
- Nombre y apellido completo.
- DNI.
- Número de beneficiario
- Domicilio (incluir la provincia).
- Número de teléfono celular del afiliado o familiar, si lo posee.
- Sello aclaratorio del médico (legible).
- Tipo de hemofilia.
- Grado de severidad. (leve, moderada, grave)
- Tipo de tratamiento (plasmático/recombinante).
- Peso actualizado.
- Dosis/kg y dosis total por aplicación (ej. 1000 u 3 veces por semana).
- Frecuencia de aplicación.
- Modalidad (profilaxis-inmunotolerancia).
- Mail de referencia de la UGP para recibir las autorizaciones de la provisión de factor VIII.
- Especificar la farmacia a la que se debe enviar la medicación, acorde al listado de farmacias disponibles para cada UGP, que se enviarán y actualizarán oportunamente.
El formulario puede ser actualizado cada 3 (tres) meses.
Los afiliados para poder retirar la medicación de la farmacia van a tener que presentar una prescripción mensual, con
sus datos y la cantidad de viales para ese mes de profilaxis. Los pedidos de factores para eventos extra-profilaxis ya sean agudos o programados, deberán ser enviados por cuerda separada y nunca ser incluidos en el mismo formulario. (ej.: usa 12 viales por mes, y necesita 4 más por una extracción dentaria, no enviar un pedido por 16 marcando profilaxis y evento). LOS PEDIDOS QUE NO CUMPLAN ESTA NORMA SERÁN RECHAZADOS.
Toda la documentación debe ser revisada por la auditoría médica de la UGP antes de ser remitida por Egov a fin de
evitar demoras por los rechazos que pudieran ocurrir por incumplimiento de normativas. Prescripción médica, historia clínica que avale la indicación y cronograma de uso, del período anterior al solicitado.

